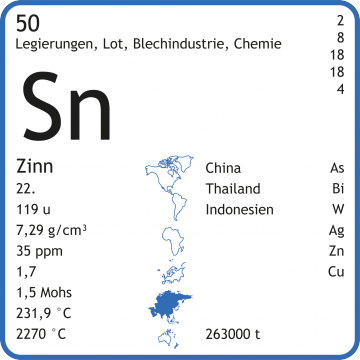
Zinn-Chemie
Nachweis
Als qualitative Nachweisreaktion für Zinnsalze wird die Leuchtprobe durchgeführt: Die Lösung wird mit ca. 20%iger Salzsäure und Zinkpulver versetzt, wobei naszierender Wasserstoff frei wird. Der naszierende, atomare Wasserstoff reduziert einen Teil des Zinns bis zum Stannan SnH4. In diese Lösung wird ein Reagenzglas eingetaucht, das mit kaltem Wasser und Kaliumpermanganatlösung gefüllt ist; das Kaliump…
» Lesen Sie mehr…

Darstellung
Zink kann – wie die meisten Metalle – mit Hilfe der Verhüttung oder der Elektrolyse hergestellt werden. Heute sind die Anteile der Welterzeugung nahezu gleich verteilt. Die Verhüttung wird zu 60%, die Elektrolyse zu 40% angewendet. Ausschlaggebend ist eigentlich nur, welche Energieform an Ort und Stelle billiger ist.…
» Lesen Sie mehr…

Eigenschaften
Zinn kann drei Modifikationen mit verschiedener Kristallstruktur und Dichte annehmen:
α-Zinn (kubisches Diamantgitter, 5,75 g/cm3) ist unterhalb von 13,2 °C stabil und besitzt einen Bandabstand von EG = 0,1 eV. Damit wird es je nach Interpretation als Halbmetall oder Halbleiter eingeordnet. Seine Farbe ist grau.
β-Zinn (verzerrt oktaedrisch, 7,31 g/cm3) bis 162 °C, Oberfläche sil…
» Lesen Sie mehr…

Verbindungen
Zinnverbindungen kommen in den Oxidationsstufen +II und +IV vor. Zinn(IV)-Verbindungen sind stabiler, da Zinn ein Element der 4. Hauptgruppe ist und zudem der Effekt des inerten Elektronenpaares noch nicht so stark ausgeprägt ist wie bei den schwereren Elementen dieser Gruppe, z. B. dem Blei. Zinn(II)-Verbindungen lassen sich deshalb leicht in Zinn(IV)-Verbindungen umsetzen. Viele Zinnverbindungen sind anorganis…
» Lesen Sie mehr…